Die kleinste Spritze der Welt
Die Gruppe von Janos Vörös hat eine Spritze im Nanometer-Massstab entwickelt, mit welcher Medikamente, DNA und RNA in einzelne Zellen injiziert werden können, ohne diese zu verletzen. Neben biologischen Anwendungen könnte das Verfahren auch zur Herstellung von Mikroelektronik oder mikroelektromechanischen Systemen (MEMS) angewandt werden. Die neue Technologie soll nun über ein Start up-Unternehmen zum marktreifen Produkt weiterentwickelt werden.
Im Verständnis der Zellen liegt der Schlüssel zum Leben, so die Meinung vieler Biologen. Wer nämlich versteht, wie eine bestimmte Krankheit in den Zellen entsteht und welche Stoffe darin für welche Prozesse verantwortlich sind, der weiss auch, welche Wirkstoffe als Therapie in Frage kommen. Standen bei dieser Suche früher vor allem Zellpopulationen im Vordergrund, so sind es heute oft einzelne Zellen.
Die Untersuchung von Einzelzellen erfordert jedoch bis heute viel manuelles Geschick: Über Mikropipetten, die mit Hilfe eines Mikromanipulators unter einem lichtstarken Mikroskop bedient werden, wird der Zelle ein potentieller Wirkstoff eingespritzt. Auch können mit derselben Apparatur feinste elektronische Signale in der Zelle gemessen werden, was wiederum Rückschlüsse auf die Aktivität von Membranproteinen gibt (Patch-Clamp-Technik). Diese Proteine sind wichtige Regulatoren in den Zellen und spielen bei der Wirksamkeit von Medikamenten eine zentrale Rolle. Biologen müssen für solche Experimente viel Erfahrung mitbringen, denn das Verfahren ist fehleranfällig und in vielen Fällen wird die Zelle bei der Manipulation beschädigt.
Sanfter Stich dank automatischer Kraftkontrolle
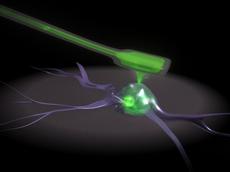
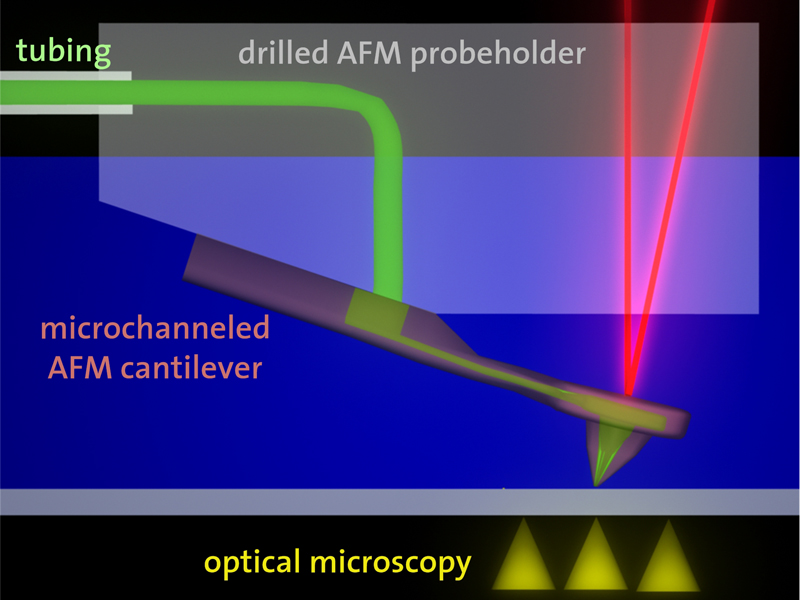
Tomaso Zambelli aus der Gruppe von Janos Vorös, Professor am Institut für Biomedizinische Technik der ETH Zürich, hat im Wissenschaftsmagazin «Nanoletters» eine Nanospritze für die automatisierte Injektion bei Zellen vorgestellt. Zambellis ursprüngliche Idee war, die Technologie des Rasterkraftmikroskops (siehe Kasten) für die Zelluntersuchung zu nutzen. Herausgekommen ist das «Fluid force microscope», nach Zambelli die zurzeit kleinste automatisierte Spritze der Welt. Im Gegensatz zum herkömmlichen manuellen System wird der Druck der Messnadel – auch Cantilever genannt - auf die Zelle genau so dosiert, dass diese nicht unnötig verletzt wird. Für die Kontrolle ist ein Laser verantwortlich, der jede Bewegung des Cantilevers registriert und die Kraft auf die Zelle mehrere 1000 Male pro Sekunde anpasst.
Dieses System funktioniert auch unter Wasser oder in anderen Flüssigkeiten, was die Bedingung ist, will man das Gerät für die Zelluntersuchung einsetzen. Um über die Nadel des Cantilevers auch Lösungen in eine Zelle einspritzen zu können, haben Wissenschaftler vom «Centre Suisse d'Electronique et de Microtechnique» (CSEM) in Neuchâtel einen Mikrokanal in den Cantilever verlegt. Die Öffnung an der Nadelspitze hat dabei noch einen Durchmesser von 200 Nanometer (ca. 500 Mal kleiner als der Durchmesser eines Haares). Über diese Spitze können zum Beispiel Medikamentenwirkstoffe, DNA oder RNA in eine Zelle injiziert werden. Gleichzeitig können über die Nadel auch Proben aus einer Zelle für die spätere Analyse entnommen werden.
Zellen in Echtzeit beobachten
Zambelli hat in einem Versuch mit Ari Helenius‘ Gruppe vom Institut für Biochemie der ETH Zürich nachgewiesen, dass mit dem «Fluid force microscope» ein Virus in eine einzige Zelle innerhalb einer Population injiziert werden kann. Geplant sind zudem Versuche, Moleküle aus Zellen zu entnehmen sowie schwache elektrische Signale an der Zelle zu messen, die wiederum Rückschlüsse auf die Aktivität von Membranproteinen erlauben. Könnte letzteres erreicht werden, so hätten Biologen eine praktische Alternative zur aufwändigen manuellen Patch-Clamp-Technik. Mit dem «Fluid force microscope» könnte es mittelfristig möglich werden, einzelne Zellen während der Injektion von Wirkstoffen in Echtzeit zu beobachten – alles mit derselben Apparatur. «Für die Biologie und die Pharmaforschung wäre dies ein riesiger Fortschritt. Damit könnte erstmals die Auswirkung von Medikamentenwirkstoffen auf Membranproteine automatisiert beobachtet werden», erläutert Zambelli.
Das Potential dieser Technologie ist laut Zambelli sehr gross. Dieser Meinung sind offensichtlich auch namhafte Hersteller von Rasterkraftmikroskopen: Bereits haben die Wissenschaftler Angebote für den Verkauf des Patents für das «Fluid force microscope» erhalten. Vörös und Zambelli haben sich aber dagegen entschieden, damit die beiden Doktoranden Michael Gabi und Pascal Behr aus Zambellis Team, die an der Entwicklung des «Fluid force microscope» beteiligt waren, das Gerät im eigens dafür gegründeten Spin-off-Unternehmen zur Marktreife weiterentwickeln können. Dafür haben sie kürzlich «Cytosurge GmbH» gegründet. Mit einem Beitrag der Förderagentur für Innovation (KTI) wurde zudem bereits eine erste Machbarkeitsstudie durchgeführt. Heute stehen zwei Prototypen des Gerätes in Zambellis Labor, die gemeinsam mit Biologen getestet werden.
Die Gründer von «Cytosurge» sind überzeugt, dass das Interesse am Gerät noch bedeutend zunehmen wird, sobald dieses vermehrt in biologischen Publikationen erscheinen wird. Neben der Biologie sehen die Gründer von «Cytosurge» aber auch Anwendungen in der Physik, Chemie und den Materialwissenschaften. Besonders für die Produktion von immer stärker miniaturisierten Mikrochips eröffnen sich durch das «Fluid force microscope» neue Möglichkeiten, da alle möglichen löslichen Substanzen und Suspensionen auf einen Träger aufgetragen werden können – und dies auch in Flüssigkeiten. Durch die Nadelspitze könnten beispielsweise hauchdünne Metall- oder elektrisch leitende Polymerspuren auf eine Oberfläche gespritzt und so elektrische Schaltungen im Nanometer-Massstab aufgebaut werden. Mit Säuren als Spritzmittel wäre auch das Wegätzen feinster Strukturen aus festen Materialien möglich. Noch müssen sich diese Ideen im Versuch erst durchsetzen, doch für die Biologie könnte mit dem «Fluid force microscope» bald eine neue Ära in der Erforschung von einzelnen Zellen beginnen.
Referenz
Meister et al.: FluidFM: Combining Atomic Force Microscopy and Nanofluidics in a Universal Liquid Delivery System for Single Cell Applications and Beyond. Nanoletters. 2009; 9: 2501–2507. doi: 10.1021/nl901384x
Rasterkraftmikroskop / Atomic force microscope (AFM)
Das Rasterkraftmikroskop ist ein wichtiges Werkzeug in der Oberflächenchemie und -physik. Mit einer Nadelspitze, die im Idealfall nur aus einem einzelnen Atom besteht, kann die Topografie von feinsten Strukturen einer Oberfläche genau untersucht werden. Man kann sich dieses Verfahren ein wenig wie einen Plattenspieler vorstellen, bei dem der Nadelspitz die Rillen der Platte abtastet. Die Kräfte, die auf die Atomnadel wirken und die Biegung des Cantilevers verursachen, werden über einen Laserstrahl gemessen, womit auch geringste Bewegungen der Nadel registriert und visualisiert werden. Das Rasterkraftmikroskop wurde 1986 von Calvin Quate, Christoph Gerber und Gerd Binnig entwickelt. Binnig und Heinrich Rohrer von IBM Zürich erhielten im selben Jahr den Nobelpreis in Physik für die Erfindung des Rastertunnelmikroskops, das als Vorgänger des Rasterkraftmikroskops gilt.








LESERKOMMENTARE